人間の脳腫瘍の深い地図状プロテオミクス
人間の脳腫瘍の深い地図状プロテオミクス
組織の細胞組成と空間的な組織構造は、その特性と機能を決定する上で重要な役割を果たします。これらの特徴を理解することは、疾病の結果を研究する上で不可欠です。最近の空間分解シーケンシング技術の進歩により、組織内の遺伝子発現パターンを特徴づけることが可能になりました。しかし、組織の異質性を完全に理解するには、遺伝子によってエンコードされるタンパク質も考慮する必要があります。質量分析イメージング(MSI)技術は、組織内のタンパク質の分布をマッピングすることができますが、完全なプロテオームデータの生成には制約があります。レーザーキャプチャーマイクロディセクション(LCM)は、単一の細胞から大きな組織領域まで、組織の特定の領域を取り出すことができる有望な解決策です。
最近、オックスフォード大学のSimon Davisらは、レーザーキャプチャーマイクロディセクションを使用して、異なる空間分解能(組織断片全体から40µmの分解能まで)で人間の脳腫瘍のプロテオームを解析しました。主な目的は、組織の特徴を発見するための深いプロテオミクスと空間的に意識した統計手法のワークフローを開発することであり、脳腫瘍の特定の生物学に焦点を当てることではありませんでした。空間的に意識した統計手法を適用することにより、組織構造や病理学の事前知識なしに、腫瘍部位内で空間的およびクラスター化された発現を有するタンパク質と経路を同定しました。さらに、彼らは腫瘍内の空間的に定義されたプロテオフェノタイプを発見し、空間的に解決した細胞外マトリックスの生物学と腫瘍周辺部における重点的な免疫応答を明らかにしました。さらに、彼らは血管の微細構造と関連したタンパク質の豊度をマッピングすることにより、がん組織内の栄養と酸素に依存した空間的プロテオームに関する知見を提供しました。この研究は、深い地図状プロテオミクスと空間的に意識した解析を組み合わせることで、疾患機序に関連する興味深い領域を同定する可能性を示しています。
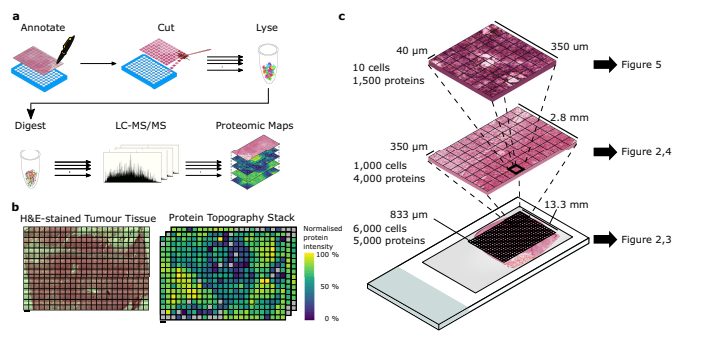
方法
適切な承諾を得てオックスフォード脳銀行から組織提供者の死後脳組織を入手しました。脳は切片され、腫瘍組織は第一および第二の冠状スライスから分離されました。腫瘍組織の最適な保存状態を判断するために、腫瘍の異なる部位からクライオ切片を取得しました。第二の冠状スライスの右上の四分割がさらなる実験のために選択されました。組織ブロックはスライドにマウントされヘマトキシリン-エオシン染色が施された後、レーザーキャプチャーマイクロスコープ(PALM MicrobeamおよびLeica LMD7システム)を装備した装置で組織解析が行われました。PALM Microbeamは10x倍率の解析に使用され、LMD7は20x倍率の解析に使用されました。PALM Microbeamでは、カットおよびキャプチャ設定においてエネルギー:43とフォーカス:55をカット、エネルギー:20とフォーカス:-15をキャプチャに使用しました。両システムから採取したサンプルは、-80℃で保存され、さらなる使用のために処理されました。LMD7システムでは、組織領域がミクロ切除され、96ウェルPCRプレートのウェルに移され、アセトニトリルで処理され、-20℃で保存されました。
サンプルは解凍され、短時間遠心分離され、残存組織を回収するためにベンゾナーゼを含むRIPAバッファで洗浄されました。その後、タンパク質は還元され、アルキル化され、パラ磁性SP3ビーズと混合されました。サンプルはアセトニトリル処理され、磁石上にビーズを固定するために振動させました。洗浄後、ビーズは再溶解され、トリプシンで一夜消化され、その後サイクロンサイザーで超音波処理されました。アセトニトリル処理と磁石への固定を再度行い、ペプチドをフィアルまたはプレートに移しました。40 µm解像度のデータでは、nドデシル-β-D-マルトシドとトリプシン/LysC Mixを含む消化バッファを使用して、1ステップの消化が行われました。得られたペプチドは、C18チップにロードしてLC-MS/MS分析が行われました。
833 µm、350 µm、40 µmの解像度を持つサンプルのペプチドは、異なるLC-MS/MSシステムを使用して分析されました。833 µmの解像度の場合、Dionex Ultimate 3000とtimsTOF Proを接続し、75 μm x 150 mmのC18カラムと流速400 nL/minを使用しました。2%のバッファBから30%のバッファBまでの17分間の線形勾配を適用し、質量スペクトルは100-1700 m/zで記録されました。 350 µmの解像度の場合、Dionex Ultimate 3000とOrbitrap Fusion Lumosを接続し、75 µm x 500 mmのC18カラムと流速250 nL/minを使用しました。2%のバッファBから35%のバッファBまでの60分間の線形勾配を適用し、MS1スキャンは400–1500 m/zの範囲で取得されました。 40 µmの解像度の場合、Evosep One LCシステムとtimsTOF SCP質量分析装置を接続し、75 µm x 150 mmのC18カラムとサイクルごとの1.07秒の流速が使用されました。 diaPASEFフレームは400–1000 m/zの質量範囲をカバーするように3つのイオンモビリティウィンドウに分割されました。
研究結果
研究者たちは、非典型性テラトイド-ラブドイド腫瘍(AT/RT)における空間的に分解されたプロテオミクスのワークフローについて説明しました。彼らは腫瘍ブロックの10 µm厚のセクションを取得し、384個の正方形の「ボクセル」に分割して解析しました。LCM(レーザーキャプチャーマイクロディセクション)を使用してそれぞれのボクセルを単独で取り出し、LCMSP3プロトコルで処理しました。彼らは5321のタンパク質を同定することができましたが、サンプルごとに同定されたタンパク質の数は異なります(空のボクセルも含む)。同定されたタンパク質は、元の位置にマッピングされました。例として、4つのタンパク質の発現パターンが腫瘍のセクション内で異なることが示されました。4306の定量化されたタンパク質に対して空間的自己相関解析が行われ、3212のタンパク質が空間的に相関した発現を示しました。研究者は、サンプリングバイアスがなく、タンパク質豊度の違いが主に組成的であることを確認しました。空間分解能を向上させるために、腫瘍内の特定の領域に焦点を当て、96の小さなボクセルで3994のタンパク質を定量化しました。この領域における4つの例のタンパク質の発現パターンは、より広範な視野のデータと一致しました。空間的に分解されたタンパク質発現データのさらなる検証には、選択された3つのタンパク質に対する免疫組織化学染色が使用されました。染色パターンは、プロテオミクスマップ内のタンパク質の強度分布に密接に似ていました。
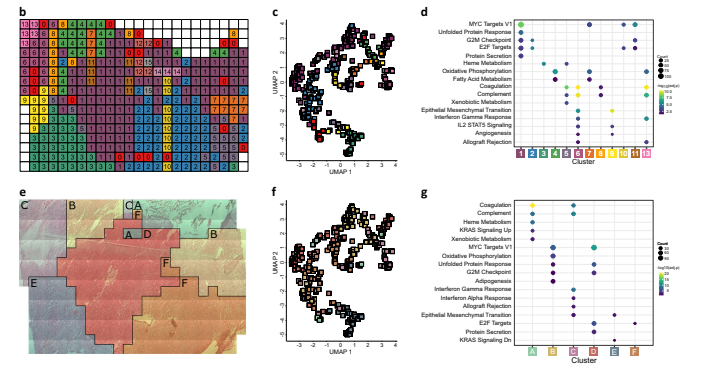
AT/RTにおける腫瘍と脳/腫瘍インターフェースの境界領域を、タンパク質定量データに基づいて異なる空間的に定義された領域として分析しました。このアプローチで同定されたクラスターはUMAPの可視化で観察された空間クラスターと一致しました。各クラスターのマーカータンパク質を決定することで、それらの機能的な違いを調査しました。固形腫瘍を表すクラスター1と2は、増殖の特徴を示すタンパク質が豊富に存在しました。一方、隣接するクラスター6および13は、免疫関連の特徴を示しました。腫瘍の境界に位置するクラスター9は、血管新生および上皮間葉転換に関連する特徴を示し、活発な腫瘍浸潤を示唆しました。免疫細胞マーカータンパク質の解析では、クラスター13に中性球マーカー、クラスター6にはプロ腫瘍のM2マクロファージマーカーのローカリゼーションが観察されました。統合プロテオミクスと空間的類似性アプローチを使用した空間クラスタリングにより、固形腫瘍、脳/腫瘍インターフェース、免疫浸潤、および出血を含む6つのクラスターが同定されました。これらのクラスターは、それぞれの機能に関連する特定の特徴を示しました。クラスタリングの結果は、異なる空間分解能で分析された場合でも一致しました。全体的に、この研究で同定されたクラスターは、AT/RTの腫瘍周辺における機能的なレイヤーを定義し、固形腫瘍、インターフェース、および周囲の領域のタンパク質豊度および機能プロセスの違いを示しています。
研究者は、1つのボクセルで表される4つの血管を含む腫瘍組織の特定の領域に焦点を当てました。彼らは、タンパク質の豊度パターンと栄養素および酸素勾配との関係を分析するために、より高い空間分解能(350µm)を使用しました。この領域はさらに9×9のグリッドに分割され、空間分解能は40µmとなりました。このサイズの各ボクセルには、5から10個の可視核が含まれ、データ非依存解析を用いて合計1550種のタンパク質が定量化されました。研究者は、各細胞から最も近い血管までの距離を測定し、血液タンパク質と血管の近接性との間に正の相関関係を見出しました。空間クラスタリング後、組織は4つのクラスタに分割され、それぞれの血管に対する近接性に基づいてセグメント化されました。豊和解析の結果、血管から遠いクラスタ1では「酸化的リン酸化」の用語が豊和され、血管に近いクラスタ2と4では、血液に関連する用語が豊和されていることがわかりました。研究者は、タンパク質GAPDHの組織全体で一定の強度を観察しました。プロテオミクスマップは、ボクセルと血管の距離と正の相関を持つタンパク質と、ボクセルと血管の距離と負の相関を持つタンパク質の2つの主要なパターンを示しました。研究者は、Alpha-2-MacroglobulinやAspartate betaなど、血管と相関し特定の空間分布を示すいくつかのタンパク質を同定しました。彼らはまた、空間的に相関し、ECMアーキテクチャに関連する経路で豊和される多くの細胞外マトリックス関連タンパク質の存在を確認しました。研究者はさらに、組織内のさまざまな亜家族間でのヘテロジェネイティのあるコラーゲンタンパク質とインテグリンタンパク質の空間的豊和を分析しました。ECMに関連するタンパク質は、非ECMタンパク質よりも高い空間的クラスタリングを示しました。全体的に、この空間解析は、腫瘍組織内のタンパク質の分布、栄養/酸素勾配、およびECMの腫瘍発達への役割に関する洞察を提供しました。
彼らの結論
本研究は、腫瘍内におけるタンパク質の空間的豊度パターンを明らかにし、腫瘍の境界の空間マーカーとなる特定のタンパク質を同定しました。さらに、本研究は、細胞外腫瘍マトリックスにおける免疫応答駆動型のタンパク質ネットワークを明らかにし、深い地形プロテオミクスが組織生物学と病理学の理解を分子レベルで再定義する可能性を示しました。本研究では、現在の空間的に解像度の高いプロテオミクス技術の限界と課題についても議論し、今後の研究の方向性を提案しています。